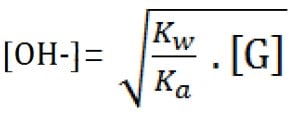Pengertian Hidrolisis Garam, Macam dan Rumus serta Contohnya – Banyak dari kita yang belum pernah mendengar hidrolisis garam. Apa sih hidrolisis garam itu? Ini memang sangat asing terdengar pada telinga kita. Namun bukan berarti ini tidak penting, ini adalah pembahasan yang sangat menarik untuk dibahas. Bagi anda yang pendidikannya berada dijurusan kimia mungkin sudah sering mendengarnya, tidak usah berlama-lama lagi, mari kita bahas sekarang.
Pengertian Hidrolisis Garam, Macam dan Rumus serta Contohnya
Mari kita bahas dulu apa itu hidrolisis garam
Pengertian Hidrolisis Garam
Hidrolisis berasal dari kata hidro artinya air dan lisis artinya penguraian. Jadi, hidrolisis adalah reaksi penguraian dalam air. Hidrolisis garam adalah reaksi penguraian garam dalam air membentuk ion positif dan ion negatif. Ion-ion tersebut akan bereaksi dengan air membentuk asam (H3O+) dan basa (OH–) asalnya. Reaksi hidrolisis berlawanan dengan reaksi penggaraman atau reaksi penetralan. Reaksi penggaraman yaitu reaksi antara asam dengan basa yang menghasilkan garam. Garam yang dihasilkan tidak selalu bersifat netral, tetapi tergantung kekuatan asam dan basa pembentuk garam tersebut.
Macam-macam Hidrolisis Garam
Jika ditinjau dari komponen pembentuk garam serta banyak tidaknya garam tersebut dapat diuraikan ketika direaksikan dengan air, maka reaksi hidrolisis dapat dibedakan sebagai berikut ini.
1. Hidrolisis Parsial
Hidrolisis parsial ialah ketika garam direaksikan dengan air hanya salah satu/sebagian ion saja yang mengalami reaksi hidrolisis, sedangkan yang lainnya tidak. Komponen penyusun garam yang mengalami reaksi hidrolisi parsial ini ialah asam lemah dan basa kuat atau sebaliknya.
2. Hidrolisis Total
Hidrolisis total merupakan reaksi penguraian seluruh garam oleh air, yang mana komponen garam terdiri dari asam lemah dan basa lemah. Berdasarkan jenis ion-ion yang dihasilkan ketika garam terlarut dalam air, proses hidrolisis dapat dibedakan menjadi beberapa macam berikut ini.
3. Hidrolisis Anion
Apabila garam yang terdiri dari komponen molekul asam lemah dan basa kuat direaksikan dengan molekul air, maka garam-garam ini hanya akan terhidrolisis sebagian/parsial didalam air dan akan menghasilkan ion yang bersifat basa (OH-). Dengan kata lain, yang terhidrolisis adalah sedangkan anion dari asam lemah sedangkan kation dari basa kuat tidak terhidrolisis.
Contoh:
CH3COONa(aq) → CH3COO–(aq) + Na+ (aq)
CH3COO– + H2O ↔ CH3COOH + OH–
Na+ + H2O → tidak terjadi reaksi
Dari contoh diatas, menjelaskan bahwa CH3COO– yang bertindak sebagai anion asam lemah terhidrolisis membentuk OH– ketika direaksikan dengan molekul air (H2O) sedangakn Na+ yang bertindak sebagai kation dari basa kuat tidak terhidrolisis ketika direkasikan dengan molekul air. Kesimpulannya garam dengan komponen pembentuk asam lemah dan basa kuat, jika direaksikan dengan air akan terhidrolisis sebagian dan menghasilkan ion yang bersifat basa.
4. Hidrolisis Kation
Serupa halnya dengan reaksi hidrolisis antara garam dengan komponen molekul asam lemah dan basa kuat direaksikan dengan molekul air, jika garam dengan komponen penyusun asam kuat dan basa lemah dilarutkan ke dalam molekul air juga akan mengalami hidrolisis parsial dan menghasilkan ion yang bersifat asam (H+). Hal ini terjadi karena hanya kation dari basa lemah terhidrolisis, sedangkan anion dari asam kuat tidak mengalami hidrolisis.
Contoh:
NH4Cl → NH4+ + Cl–
NH4+ + H2O ↔ NH4OH + H+
Cl– + H2O → tidak terjadi reaksi
Berdasarkan contoh diatas, dapat dijelaskan bahwa NH4+ yang bertindak sebagai basa lemah terhidrolisis menghasilkan ion yang bersifat asam, yakni H+. Sedangkan Cl– yang sebagai anion asam kuat tidak terhidrolisis.
5. Kation dan Anion Terhidrolisis
Apabila garam dengan komponen asam lemah dan basa lemah direaksikan dengan molekul air akan mengalami hidrolisis total. Hal tersebut dapat terjadi dikarenakan kation dari basa lemah maupun anion dari asam lemah dapat terhidrolisis secara sempurna. Reaksi hidrolisis ini menghasilkan ion H+ atau OH–.
Contoh:
CH3COONH4 → CH3COO– + NH4+
CH3COO– + H2O ↔ CH3COOH + OH–
NH4+ + H2O ↔ NH4OH + H+
Contoh diatas, menjelaskan bahwa kedua komponen penyusun garam CH3COO– (anion dari asam lemah) dan NH4+ (kation dari basa lemah) dapat terhidrolsis secara sempurna yang masing-masing berurutan menghasilkan ion yang bersifat basa (OH–) dan ion yang bersifat asam (H+).
Perlu untuk diketahui, bahwasanya garam dengan komponen asam kuat dan basa kuat yang direaksikan dengan molekul air tidak akan mengalami hidrolisis, dalam arti lain reaksi tersebut bersifat netral. Peristiwa ini dapat terjadi ketika garam yang mengandung ion logam alkali atau ion logam alkali tanah (kecuali Be2+) dan basa konjugat suatu asamkuat (misalnya, Cl–, Br–, dan NO3–) direaksikan dengan molekul air akan menghasilkan larutan yang bersifat netral.
Rumus Hidrolisis Garam
Hidrolisis adalah peristiwa suatu senyawa kimia dipecah oleh molekul air. Dalam hidrolisis garam, air terbentuk ketika suatu asam dan basa dicampur. Tidak semua suatu zat asam dan basa yang dicampur dalam air mengalami perhitungan pH hidrolisis garam. Adapun syarat bahwa perhitungan pH hidrolisis sebagai berikut.
- Garam berasal dari asam lemah dan basa kuat
- Garam berasal dari asam kuat dan basa lemah
- Garam berasal dari asam lemah dan basa lemah
Pada kenyataannya sangat sulit membedakan perhitungan pH hidrolisis garam dengan larutan penyangga (buffer). Berikut ulasan perbedaannya:
- Pada perhitungan pH hidrolisis dan buffer keduanya memakai konsep MBS (Mula-mula, Bereaksi, Sisa).
- Perhitungan pH hidrolisis pada bagian “Sisa” akan tersisa jumlah mol garam dan air di bagian produk, sedangkan jumlah mol asam dan basa habis bereaksi di bagian reaktan.
- Perhitungan pH larutan penyangga pada bagian “Sisa” akan tersisa jumlah mol spesi lemah (asam lemah atau basa lemah), garam, serta air, sedangkan jumlah mol spesi kuat (asam kuat atau basa kuat) habis bereaksi
Untuk memahaminya, perhatikan contoh berikut.
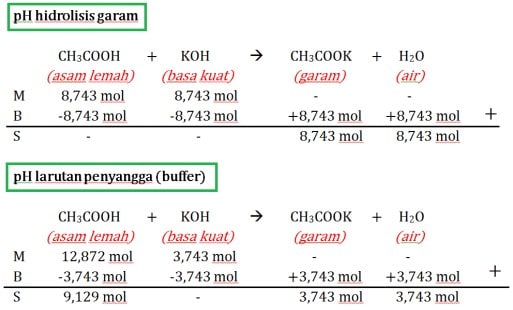
A. pH garam dari asam kuat dan basa kuat
- Tidak mengalami reaksi hidrolisis
- pH garam jenis ini adalah netral (pH = 7)
B. pH garam dari asam lemah dan basa kuat
- pH garam jenis ini adalah daerah basa (pH > 7)
- Mengalami reaksi hidrolisis parsial atau setengah, yaitu pada spesi lemah (asam lemah)
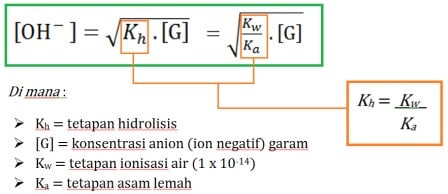
- Dalam rumus pH hidrolisis jenis ini, konsentrasi ([G]) berdasarkan rumus di bawah adalah anion dari garam itu sendiri. Contoh garam CH3COOK, maka anionnya adalah CH3COO- dan konsentrasi CH3COO– inilah yang dimasukkan ke rumus, bukan konsentrasi CH3COOK. Contoh lain adalah (CH3COO)2Ba, maka anionnya adalah 2CH3COO– dan konsentrasi CH3COO– ini dimasukkan ke rumus yaitu 2 kalinya konsentrasi (CH3COO)2Ba
Rumus Hidrolisis Bersifat Basa
C. Garam dari asam kuat dan basa lemah
- pH garam jenis ini adalah daerah asam (pH < 7)
- Mengalami reaksi hidrolisis parsial atau setengah, yaitu pada spesi lemah (basa lemah)
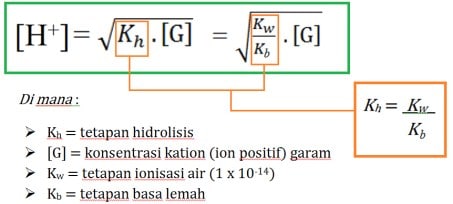
- Dalam rumus pH hidrolisis jenis ini, konsentrasi ([G]) yang dimasukkan ke rumus adalah konsentrasi kation dari garam itu sendiri. Contoh garam AlCl3, kationnya adalah Al3+ maka [G] yang dimasukkan adalah konsentrasi Al3+, bukan konsentrasi AlCl3. Contoh lain adalah garam Al2(SO4)3, kationnya adalah ion 2Al3+ maka [G] yang dimasukkan ke rumus adalah konsentrasi Al3+ yaitu 2 kalinya dari konsentrasi Al3(SO4)3
Rumus pH Hidrolisis bersifat Asam
D. Garam dari asam lemah dan basa lemah
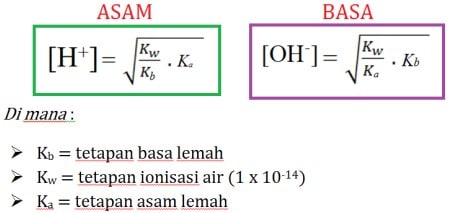
- pH hidrolisis ini tidak bergantung terhadap konsentrasi asam atau basa karena dalam spesi lemah (asam lemah dan basa lemah), nilai pH-nya ditentukan oleh tinggi atau rendahnya tetapan asam/basa (Ka atau Kb)
- Jika Ka = Kb, maka pH = 7
- Jika Ka > Kb, maka pH < 7 (dalam rumus di bawah adalah label “ASAM”)
- Jika Ka < Kb, maka pH > 7 (dalam rumus di bawah adalah label “BASA”)
Rumus Hidrolisis Lemah
E. Derajat hidrolisis garam
Derajat hidrolisis garam menunjukkan seberapa banyak suatu garam terurai dalam reaksi asam-basa (netralisasi). Derajat hidrolisis garam ini hanya berlaku pada asam lemah dan basa lemah. Hal ini dikarenakan pada garam yang berasal dari 2 spesi lemah (asam lemah dan basa lemah) rentang derajat ionisasi hidrolisisnya berkisar 0 < α < 1. Beda halnya dengan garam dari 1 spesi lemah dan 1 spesi kuat, nilai derajat ionisasi hidrolisisnya (sangat) mendekati 1.

F. Cara menentukan sifat suatu garam
Suatu garam dapat ditentukan sifatnya ada 2, yaitu:
- Melalui perhitungan = berdasarkan rumus-rumus di atas
- Konsep (tidak berlaku untuk garam dari asam lemah dan basa lemah) = lihat saja spesi kuat dari garam tersebut. Jika spesi kuatnya adalah asam berarti garam bersifat asam; jika spesi kuatnya adalah basa berarti garam bersifat basa; dan jika spesi kuatnya adalah asam dan basa berarti garam bersifat netral.
Contoh Soal Hidrolisis Garam
Disini akan kita berikan sedikit contoh soal untuk mengasah sedikit materi yang sudah dibahas diatas.
Contoh Soal 1
Besar [OH-] dalam larutan garam yang berasal dari asam lemah dan basa kuat …
A. Berbanding lurus dengan Ka-nya
B. Berbanding terbalik dengan Ka-nya
C. Berbanding lurus dengan akar kuadrat Ka-nya
D. Berbanding terbalik dengan akar kuadrat Ka-nya
E. Berbanding terbalik dengan konsentrasi molar garamnya
Pembahasan:
[OH–] dalam garam dari asam lemah dan basa kuat adalah mengitung [OH–] untuk garam bersifat basa. Dan, [OH–] berbanding terbalik dengan akar Ka-nya, berbanding lurus dengan [G].
rh2
Contoh Soal 2
Larutan NH4NO2 0,01 M mempunyai pH sebesar … (Kb NH4OH = 10^-5 dan Ka HNO2 = 10^-4)
A. 9,5
B. 8,0
C. 6,5
D. 5,5
E. 4,0
Pembahasan:
Mungkin sekian dulu pembahasan kita tentang Pengertian Hidrolisis Garam, Macam dan Rumus serta Contohnya. Semoga artikel ini dapat sangat membantu anda semua dalam memahami hidrolisis garam baik dari rumus dan macam-macamnya. Baca juga artikel StudiNews lainnya untuk materi yang berkaitan ataupun materi yang lain. Sekian dan terimakasih.